ДНК-тесты прошли длинный путь: от первых открытий в лабораториях до доступных домашних наборов. В этой статье простое объяснение, где ДНК-тесты реально помогают, чего ждать не стоит, как защищать приватность и к чему ведёт персонализированная медицина. Фокус — ДНК-тесты и всё, что вокруг них.
ДНК-тесты: от открытия к криминалистике
ДНК — носитель наследственной информации. После описания двойной спирали (1953) исследования ускорились, и к 1980-м анализ ДНК уже использовали для установления родства и в расследованиях.
В 1984 году появился метод ДНК-дактилоскопии: по уникальным участкам молекулы составляют «генетический паспорт». Это позволило уверенно идентифицировать людей по следам биоматериала и раскрывать «висящие» дела. Сегодня базы ДНК-профилей и алгоритмы сопоставления стандарт криминалистики во многих странах.
Эволюция ДНК-тестов — ключевые вехи
- 1860-е — выделение вещества, позже названного ДНК.
- 1953 — открытие двойной спирали ДНК.
- 1977 — метод секвенирования Сенгера.
- 1984 — ДНК-дактилоскопия для идентификации личности.
- 1985 — ПЦР: «копирование» ДНК для анализа.
- 2000-е — SNP-анализ: поиск вариаций, связанных с рисками болезней.
- 2007 — старт домашних ДНК-тестов для потребителей.
- 2022 — завершение расшифровки генома человека.
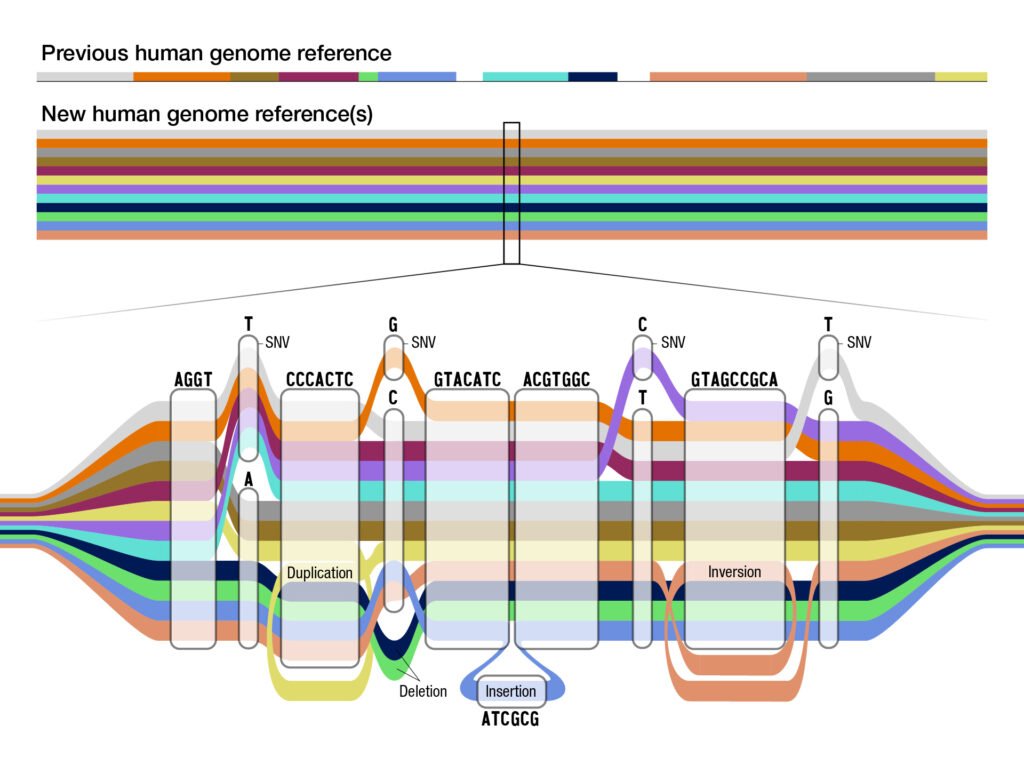
- 2023 — черновой пангeном: эталон, учитывающий разнообразие.
ДНК-тесты в медицине: ПЦР, SNP и секвенирование
ПЦР сделала анализ возможным даже при крошечных количествах ДНК. SNP-тесты ищут точечные вариации, связанные с рисками наследственных заболеваний. ДНК-тесты здесь работают лучше всего, когда есть доказанная связь мутации и болезни (например, BRCA1/BRCA2 и риск рака молочной железы). Для многофакторных болезней (сердечно-сосудистые, диабет) результаты всегда читаются в контексте образа жизни и других факторов.
Секвенирование — это «полное чтение» ДНК. После классического метода Сенгера появились более быстрые технологии, а проект «Геном человека» дал основу для клинической генетики и фармакогенетики — подбора лекарств и доз с учётом генов.
Новое о секвенировании и эталонах. В 2023 году консорциум Human Pangenome Reference представил «пангeномный» эталон — десятки полных сборок от людей разного происхождения. Такой эталон лучше покрывает сложные участки ДНК и повышает точность поиска вариантов. В 2024–2025 годах UK Biobank завершил секвенирование почти полумиллиона геномов: это база для исследований редких и частых вариантов и оценки полигенных рисков на большом массиве данных.
Нюанс: полигенные риски (PRS). Исследования показывают, что точность PRS зависит от состава обучающих данных и «переносимости» между популяциями. Это полезный дополнительный слой риска, но ему нужна калибровка и понятные форматы отчётов для врача и пациента.
Домашние ДНК-тесты: польза, цена и ограничения
Первые потребительские наборы появились в 2007 году. Тогда они стоили ~$999—$2500, сейчас базовые от ~$100. В России обычно 10–30 тыс. ₽ (во время акций меньше). Что дают такие ДНК-тесты? Отчёты о происхождении и дальних родственниках, носительство отдельных вариантов, ориентировочные риски. Чего не дают: «диагноза по слюне» и универсальных ответов для многофакторных болезней — решения по лечению всегда обсуждаются с врачом.
ДНК-тесты: как изменилась доступность
Регуляторика. В 2018 году FDA разрешило прямые потребительские фармакогенетические отчёты 23andMe (33 варианта в генах метаболизма). В 2020-м компания получила 510(k)-разрешение на информативные отчёты по отдельным лекарствам (клопидогрел, циталопрам) — материалы «для сведения», решения о терапии принимает врач.
Приватность. После громкой утечки 2023 года (затронуты миллионы пользователей) компания столкнулась с исками и штрафами: в Великобритании регулятор выписал штраф, в США обсуждается расширенное урегулирование претензий. Вывод: прежде чем включать «поиск родственников» и обмен профилями, проверьте настройки видимости и политику удаления данных.
Домашние ДНК-тесты: мифы и факты
ДНК-тесты и будущее персонализированной медицины
Фармакогенетика уже помогает подбирать лекарства и дозы, снижая риск побочных эффектов. В 2024 году в Англии заработала сеть по фармакогеномике (Network of Excellence), а проект PROGRESS расширился в 2025-м: предиктивные панели для первичного звена, интеграция рекомендаций в системы назначения (ProgressRx). По результатам фазы I примерно у четверти пациентов назначения менялись с учётом генотипа; сейчас идёт масштабирование по стране.
Быстрое секвенирование генома в реанимациях новорождённых сокращает путь к диагнозу и меняет тактику лечения. Параллельно стартовала программа геномного скрининга новорождённых в Англии: 100 тыс. детей, более 200 состояний, обсуждение этики, хранения и вторичного использования данных.
Заключение
ДНК-тесты стали доступнее и ближе к повседневной жизни. В криминалистике — это стандарт. В медицине — сильный инструмент там, где связь мутации и болезни доказана, и осторожный помощник при многофакторных рисках. Домашние наборы дают полезную информацию, но не заменяют консультации. За персонализированной медициной будущее, а значит — важны корректная интерпретация результатов и внимательное отношение к приватности.